金波?抗HPV生物蛋白敷料-应用于HPV的基础研究论文
化学修饰的牛β-乳球蛋白可抑制人乳头瘤病毒感染
摘要:既往研究显示,3-羟基邻苯二甲酸酐修饰的牛β-乳球蛋白有望成为新的抗-HIV杀微生物剂。本研究发现,这一被命名为JB01的化学修饰蛋白在抗人乳头瘤病毒(HPV)感染中表现出高效的抗病毒活性,包括HPV 6、HPV 16和HPV 18三种亚型。JB01的抗HPV活性与其表面赖氨酸和精氨酸残基的修饰比例紧密相关。JB01蛋白在浓度为1 mg/ml时无任何细胞毒性,且在室温和37℃条件下均保持不少于12周的高度稳定性。这些结果表明,JB01极有望被开发成为一种安全、有效且低廉的抗病毒制剂,用于HPV感染的改善和预防。
关键词:3-羟基邻苯二甲酸酐;化学修饰;牛β-乳球蛋白;HPV感染;子宫颈癌;抗-HPV制剂
1. 引言
从全球而言,子宫颈癌是女性中第三大高发癌症,每年约有274,000例女性死于该病[1]。在发展中国家,这一情况更为严重,子宫颈癌在15-44岁女性癌性死亡原因中名列第2[2]。在中国,每年约有135,000例新发子宫颈癌女性患者,近50,000例患者死于该病,约占全球死亡总数的18%[3]。特别是近10年来,子宫颈癌发病率迅速升高,严重威胁中国女性的健康。因此,亟需研发出一种安全、有效的生物制剂,用以预防子宫颈癌发生。
人乳头瘤病毒(Human papillomavirus,HPV)是目前公认的造成子宫颈癌的罪魁祸首[4]。HPV是一种无包膜小病毒,大小约为55nm,内含双链DNA。整个基因组由三个区域组成。E和L域分别控制早期和晚期病毒复制,而LCR域则负责调节基因功能[5]。到目前为止,已发现超过100种不同亚型的HPV,它们可以进一步划分为高危型和低危型[6]。鉴于HPV 6和11主要会引起良性生殖器疣和轻度宫颈上皮坏死,故将其归为低危型HPV。相反, HPV 16和HPV 18被列为高危型,因为它们可引发超过总数的70%以上的子宫颈癌[7,8]。
HPV通常会感染人皮肤和粘膜组织复层上皮的基底细胞,特别是在口、手、足和生殖器部位。病毒与人类细胞间的直接接触是病毒入侵的必要条件。当皮肤或粘膜受损时,游离的成熟HPV颗粒即有机会穿透轻微创伤部位,与组织细胞结合而感染。一般而言,这就是HPV生命周期的开始,同时也是预防病毒感染的最佳阶段。HPV预防性疫苗现已在100多个国家获批[9]。尽管如此,因其改善费用高且不能有效预防所有HPV亚型,导致其在低收入、发展中国家应用受限。此外,目前还没有任何一种可局部抑制HPV感染的制剂,因此研发此类制剂势在必行。
我们的既往研究显示,3-羟基邻苯二甲酸酐修饰的牛β-乳球蛋白,即本文中的JB01,可有效抑制HIV、HSV-1、HSV-2、以及某些衣原体[10-13]。本研究中针对JB01蛋白抑制HPV感染的活性进行了检测。结果证实,JB01具有高效的抗病毒活性,可有效抑制HPV6、HPV16和HPV18感染。我们的既往研究还表明,该化学修饰蛋白不仅价格低廉,且在水溶液中高度稳定,易于制成外用凝胶制剂[10,14]。因此,我们相信,JB01有望被进一步开发成为一种安全、有效且价格低廉的外用生物制剂,用于HPV感染的预防和改善。
2. 材料和方法
2.1 试剂
自Sigma公司(圣路易斯,密苏里州,美国)购买3-羟基邻苯二甲酸酐、牛β-乳球蛋白、胰蛋白酶-琼脂糖珠、XTT [2,3-双(2-甲氧基-4-硝基-5-磺基苯)-5-[(苯胺基)羧基]-2氢-四唑氢氧化物]和2,4,6-三硝基苯磺酸(trinitrobenzenesulfonic acid,TNBS),自Fisher Scientific 公司(Valley Park,VA)购买对一水合羟苯基乙二醛。TZM-b1细胞,是人工改造的高度表达CD4及两种共受体CXCR4和CCR5的HeLa-细胞系、同时还稳定转染了长末端重复序列(LTR)-驱动萤火虫荧光素酶;293FT细胞,一种含SV40大T抗原可快速生长的293T细胞系变种,均由美国国立卫生研究院下属的艾滋病研究与相关试剂组提供。VK2/E6E7细胞(一种永生化阴道上皮细胞系)购自美国菌种保藏中心(American Type Culture Collection,ATCC)(弗吉尼亚,马纳萨斯)。
2.2 JB01制备和鉴别
利用先前描述的方法制备JB01蛋白[10]。简言之,即将牛β-乳球蛋白溶于0.1 M磷酸盐缓冲液(pH 8.5),配制成最终浓度为20 mg/ml的溶液。之后将3-羟基邻苯二甲酸酐二甲基甲酰胺饱合溶液缓慢加入该溶液内并轻轻摇动。将溶液分为5份,分别配制成3-羟基邻苯二甲酸酐最终浓度为0、10、20、40和60 mM的溶液(如表1所示)。将混合物放在室温下静置1 h,经磷酸盐缓冲液(phosphate buffer saline,PBS)充分透析后,利用0.45 μm 注射器式过滤器(Acrodisc;Gelman Sciences,Ann Arbor,MI)进行过滤。采用BCA蛋白定量分析试剂盒(Pierce,Rockford,IL)测定蛋白浓度。
采用如前所述的TNBS分析法,定量测定修饰后或未修饰的蛋白中赖氨酸残基比例[15]。简言之,即在室温(room temperature,RT)下,用25 μl Na2B4O7(0.1 M)处理25 μl 酸酐修饰或未修饰蛋白(90 μM)5 min。之后将10 μl TNBS加入混合物内。再过5 min后,加入100 μl终止液(0.1M NaH2PO4和1.5mM Na2SO3)终止反应。利用酶标仪(Ultra 384;Tecan,Research Triangle Park,NC)测定420 nm(A420)处吸光度。另外,采用先前的描述方法,检测精氨酸残基修饰比例[16]。简言之,即将90 μl酐修饰或未修饰蛋白(90 μM)溶于0.1 M 磷酸钠溶液(pH 9.0),之后用10 μl 50 mM p-HPG在RT、黑暗条件下处理90 min。测定340 nm(A340)处吸光度。
2.3 JB01对HPV感染抑制活性的检测
采用先前所述方法,将含密码子修饰HPV L1和L2基因共转染至293FT细胞内,生成HPV假病毒[17]。之后,在37 ℃条件下用JB01或对照蛋白对100个TCID50(50%组织培养感染量)HPV 6、HPV 16和HPV 18假病毒进行30 min孵化。再将混合物加至含10% FBS DMEM培养基内的1×105/ml 293FT 细胞内,过夜。第2天,去除培养上清液,加入新鲜培养基。感染后第3天,收集细胞并50 μl裂解试剂进行裂解。利用荧光素酶试剂盒(Promega,Madison,WI)和光度计(Ultra 386;Tecan,Durham,NC),参照产品说明书,完成荧光素酶活性分析测定。利用CalcuSyn软件计算JB01的IC50s[18]。
2.4 细胞毒性分析
利用如前所述的XTT比色法,测定JB01对TZM-b1和VK2/E6E7细胞产生的细胞毒性[19,20]。简言之,即利用含等容积(105个细胞/ml)细胞的96-孔板,将各级别浓度100μl复合物加入孔中的细胞内。在37 ℃条件下孵化4天后,加入含0.02 μM吩嗪硫酸甲酯的50 μl XTT溶液(1 mg/ml)。经过4 h后,利用酶标仪测定450 nm处吸光度,并计算细胞毒性比例。
3. 结果
3.1 3-羟基邻苯二甲酸酐修饰带正电赖氨酸和精氨酸残基比例与JB01的抗-HPV活性相关
β-乳球蛋白含有162个残基,分子量为18.4 kDa,内含18个带正电残基,包括15个赖氨酸残基和3个精氨酸残基。我们的既往研究证明,JB01上化学修饰赖氨酸残基数量是其抗-HIV-1活性的重要决定因素[21]。本研究也证实,无论是赖氨酸还是精氨酸残基的比例,都对JB01的抗-HPV活性有重要意义。如表1所示,随着3-羟基邻苯二甲酸酐浓度的升高,赖氨酸和精氨酸残基被修饰的数量逐渐增加,JB01抗-HPV活性亦随之增强。采用60 mM 3-羟基邻苯二甲酸酐处理时,分别约有90%和95%的赖氨酸和精氨酸残基被修饰,可产生最强的HPV 16感染抑制作用(IC50 = 0.027 μM)。因此,后续的研究均采用这一浓度的3-羟基邻苯二甲酸酐完成β-乳球蛋白的修饰处理。
3.2 JB01可有效抑制HPV6、HPV 16和HPV18感染
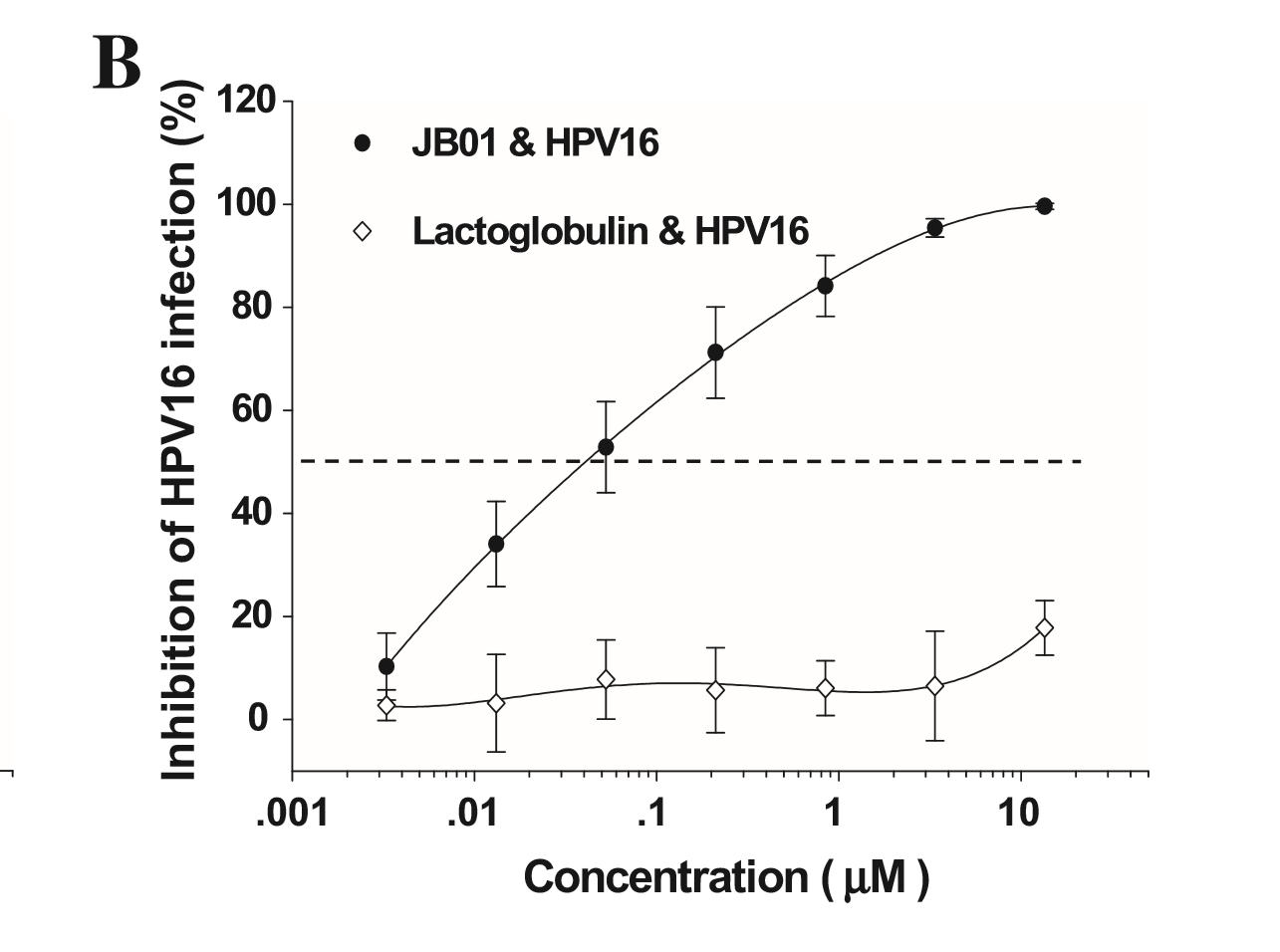
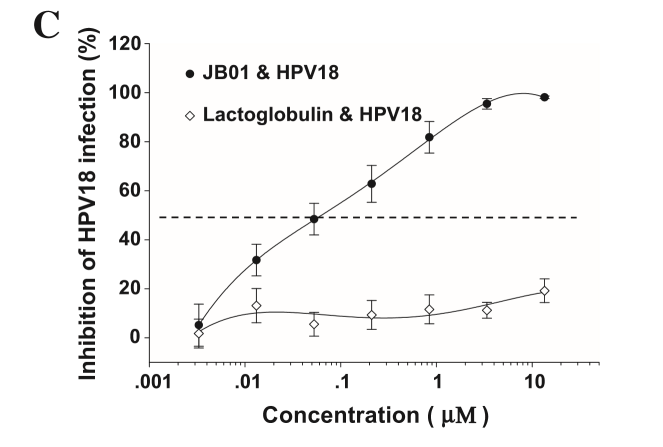
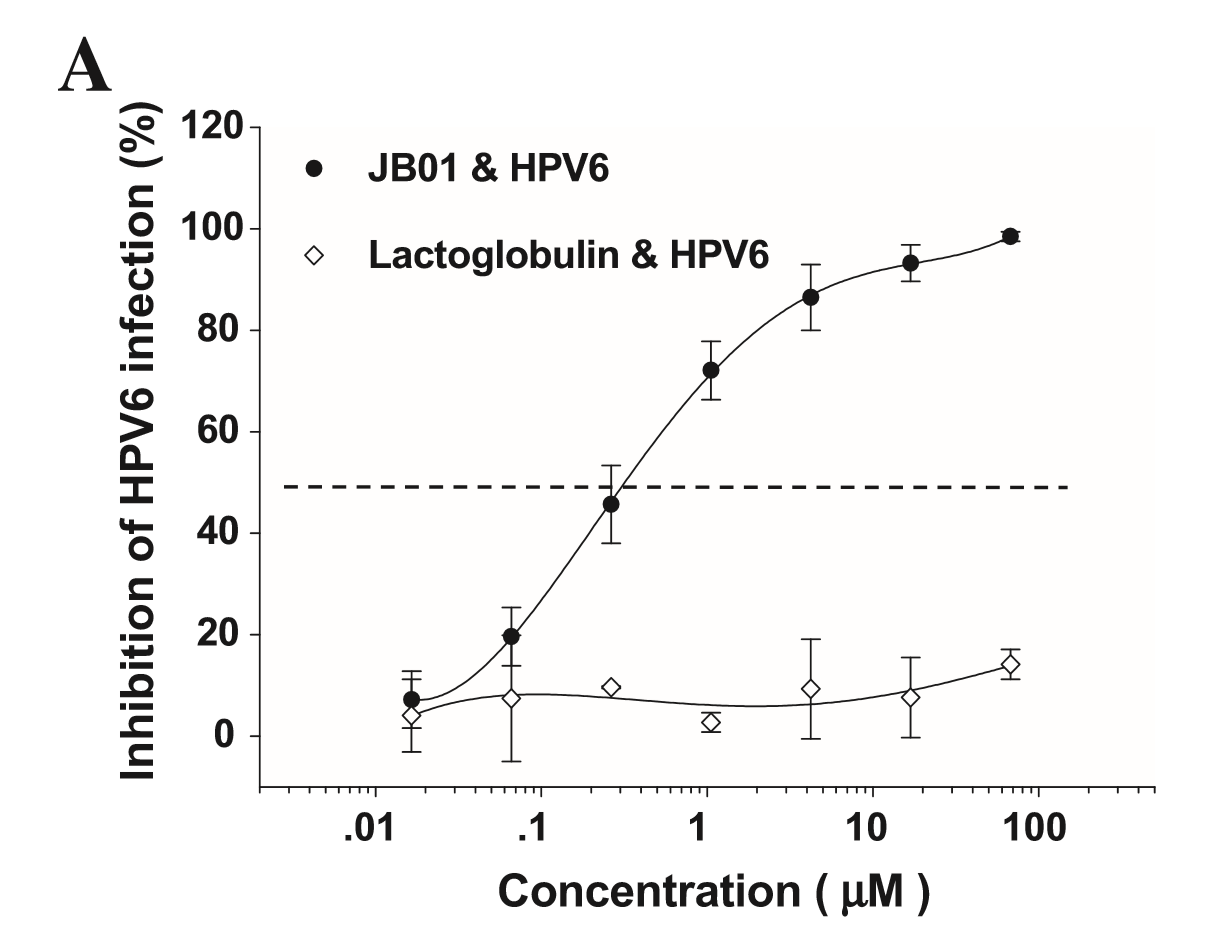
接下来的研究检测了JB01对可导致生殖器疣的HPV 6及公认的可导致子宫颈癌的高危型HPV16和HPV18的抑制活性[7,8]。如图1所示,对于所有这三种HPV亚型,即HPV6、HPV 16和HPV 18,JB01都表现出了高效的抗病毒活性,IC50分别为0.33、0.04、和0.065 μM。这些结果表明,JB01可有效抑制导致人类疾病的主要的HPV亚型。
3.3 JB01稳定且细胞毒性低
作为可应用于临床的产品,抗-HPV制剂的稳定性和安全性是其研发中要解决的重要问题。在评价JB01稳定性时,我们分别将JB01蛋白在室温(24℃)及人体温(37℃)温度条件下放置12周,并于第1、2、3、4、6、和12周时测定其抗-HPV活性。结果显示,12周贮藏期内,JB01抗-HPV活性无显著变化,即证明JB01高度稳定(图2A)。
之后,研究又利用未修饰β-乳球蛋白作为对照组,进一步评价了JB01对人宫颈癌细胞系(HeLa细胞)衍生TZM-b1细胞和VK2/E6E7细胞(阴道上皮细胞)的细胞毒性。如图2B所示,JB01对上述人宫颈细胞和阴道上皮细胞无明显细胞毒性,这意味着它和未修饰β-乳球蛋白一样安全。
4. 讨论
虽然HPV并不会感染未受损粘膜上皮细胞,但可感染受损粘膜上皮细胞。在其衣壳蛋白L1和L2作用下,该病毒可通过独特机制感染复层上皮的基底细胞。首先,L1蛋白与上皮损伤后暴露基底膜(basement membrane,BM)上的硫酸乙酰肝素蛋白多糖(heparan sulfate proteoglycan,HSPG)结合,引发弗林蛋白酶切割L2蛋白,并与L1结合后在角质化细胞表面形成尚未明确的受体,进而引发新的复制循环[22]。因此,采用含抗-HPV成分外用制剂涂抹生殖器粘膜表面这一方法有望阻断新的HPV感染,籍此有效预防和改善HPV感染。
由于L1和L2蛋白表达要求复层鳞状上皮组织的上层出现细胞分化[22],因此HPV无法在常规单层细胞培养中复制。但可利用基于HPV的假病毒对HPV生命周期的早期进行观察[17]。本研究采用HPV假病毒系统评价了JB01对293FT细胞HPV感染的抑制活性。研究发现,JB01可高效抑制多种类型HPV感染,包括HPV 6、HPV 16和HPV 18。JB01内修饰赖氨酸和精氨酸残基的比例与其抗-HPV活性密切相关,这意味着JB01的净负电荷在JB01介导HPV感染抑制效应中具有重要作用。这些结果表明,JB01可通过β-乳球蛋白上带负电残基与L1和/或L2蛋白上带正电残基的交互作用,阻止HPV进入靶细胞内。据此我们推测,L1蛋白的C末端结构域与L2蛋白的N-末端结构域有可能是JB01的作用靶点,因为这两个结构域都含有暴露于病毒衣壳表面的带正电残基[23,24]。事实上,研究亦发现,JB01可与HPV L1和L2蛋白上的带正电残基牢固结合,而未修饰β-乳球蛋白与这些肽间未观察到明显的结合作用。
总之,本研究证明,作为一种表面负电荷量相对增多(对带正电残基进行化学修饰的结果)的化学修饰β-乳球蛋白,JB01可有效抑制HPV感染,其机制很可能是靶向作用于病毒复制早期、特别是病毒进入过程。作为一种廉价、安全且稳定的抗-HPV剂,可将JB01制成外用凝胶制剂,用于生殖粘膜HPV感染的预防和改善,进而降低子宫颈癌的发病率。
致谢
感谢美国国立卫生研究院Dr. John为我们提供用以制备HPV 6、HPV 16和HPV 18假病毒的质粒。感谢美国国立卫生研究院下属的艾滋病研究与相关试剂组为我们提供TZM-bl细胞和293FT细胞。本研究由中国国家自然科学基金(81173098 SJ#81102476 LL)、中国973计划(#2012CB519001 SJ)及“Chen Guang” Project of SMEC and SEDF(11CG03)to LL资助。
图释
|
|
|
|
|
|
图1. JB01对HPV感染的抑制活性,包括HPV6(A)、HPV16(B)和HPV18(C)病毒。将标本分成将标本分成3份完成测定,并重复实验至少2次。图中数据为代表性实验三份测定值的均数± SD。
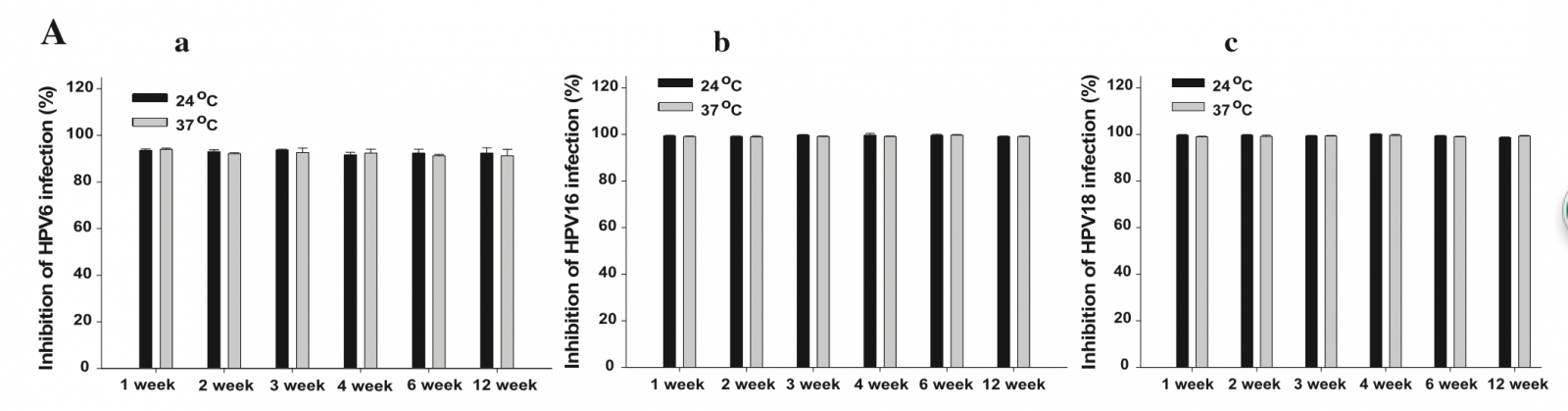
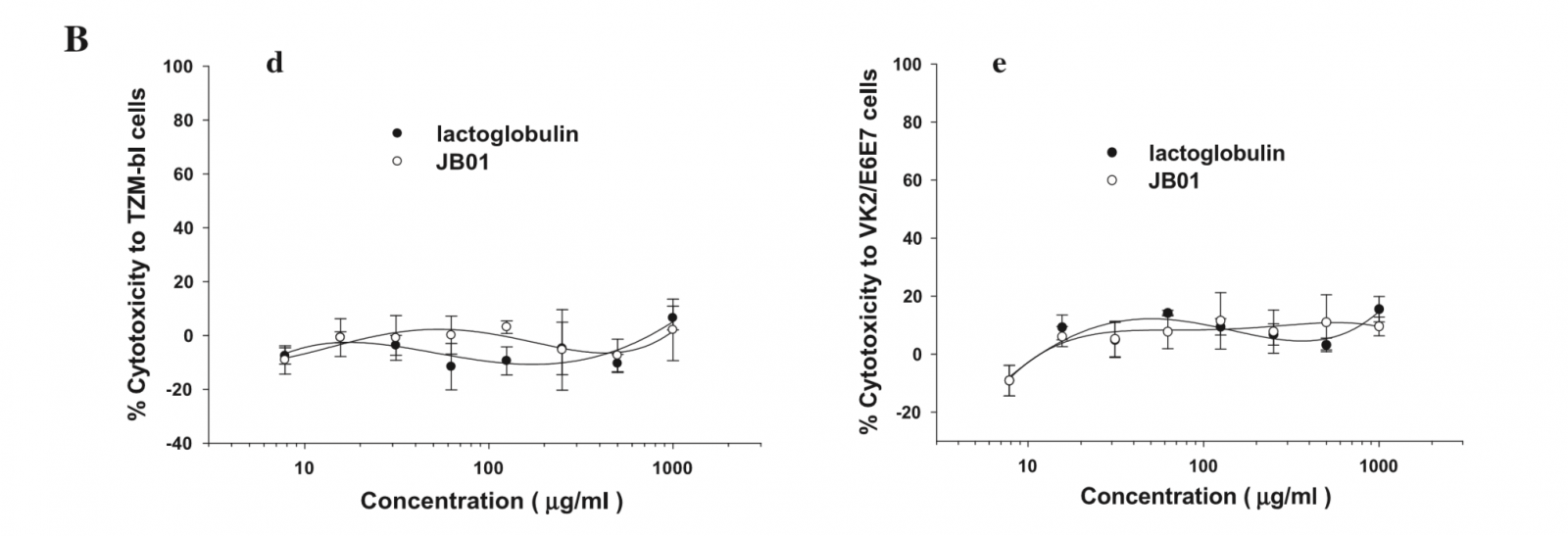
图2. JB01的稳定性和细胞毒性。(A)JB01的稳定性。分别将JB01放置在24和37℃条件下贮存1-12周,各指示时点其抗HPV6(a)、HPV16(b)和HIV18(c)感染的抗病毒活性如图所示。(B)JB01的细胞毒性。采用XTT比色法测定JB01对TZM-B1细胞(d)和VK2/E6E7细胞(e)的可能毒性反应。利用未修饰β-乳球蛋白作为对照。将标本分成3份完成测定,并重复实验至少2次。图中数据为代表性实验三份测定值的均数± SD。
|
表1. 3-羟基邻苯二甲酸酐(HP)修饰β-乳球蛋白抗-HPV活性与其修饰残基比例的对照 |
||||
|
HP(mM)浓度 |
修饰残基(%) |
抑制下述病毒感染的IC50(μM) |
||
|
赖氨酸 |
精氨酸 |
HPV6 |
HPV16 |
|
|
0 |
0 |
0 |
>20 |
>20 |
|
10 |
35.2 |
47.3 |
>20 |
10.432±1.54 |
|
20 |
51.3 |
66.2 |
4.117±0.531 |
1.321±0.231 |
|
40 |
79.6 |
85.9 |
0.983±0.125 |
0.125±0.036 |
|
60 |
90.1 |
95.2 |
0.269±0.073 |
0.027±0.008 |
|
a 每份样本都分成三份进行测定,实验重复两次。表中所示数据为代表性实验三份测定值的均数 ± SD。 |
||||
联系电话:
微信:setyfwn
下一篇:蜀留香自助火锅加盟费用